📢Dengyue Pharma le trae las últimas noticias:
El 1 de diciembre de 2025, la Administración Nacional de Productos Médicos (NMPA) aprobó oficialmente la inyección de Picankibart para el tratamiento de pacientes adultos con psoriasis en placas de moderada a grave que son elegibles para terapia sistémica.
Esta aprobación representa un gran avance en el campo del tratamiento de la psoriasis en mi país, ofreciendo a los pacientes una opción de tratamiento innovadora, más segura y efectiva.
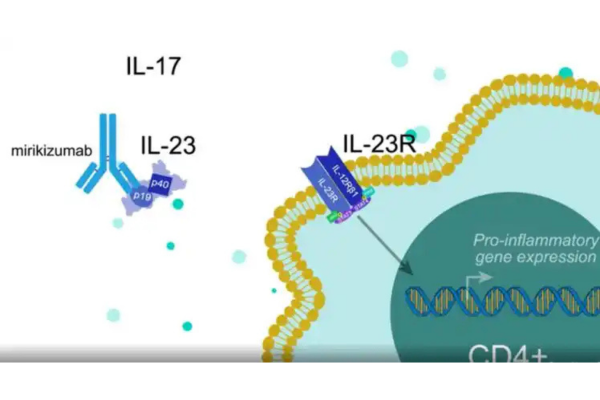
Dirigido a la subunidad IL-23p19 para una regulación precisa de la respuesta inmune
Picankibart inyectable es un anticuerpo monoclonal IgG1 humanizado que se une específicamente a la subunidad p19 de la IL-23, bloqueando la unión de la IL-23 a su receptor y, en consecuencia, inhibiendo la liberación de factores proinflamatorios posteriores (como IL-17 e IL-22). De esta manera, se bloquea la respuesta inflamatoria en la psoriasis desde su origen.
En comparación con ustekinumab, que se dirige a la subunidad p40 de la IL-23, Picankibart tiene una diana más específica, lo que reduce la interferencia con la vía no patógena de la IL-12 y disminuye el riesgo de infección.
Estudios preclínicos han demostrado que tiene mayor afinidad por la IL-23p19 que otros anticuerpos monoclonales y una vida media más larga, lo que resulta en una eficacia más duradera.
Inicio de acción rápido y alta tasa de eliminación de lesiones a largo plazo
Dos estudios clínicos de fase III (PILOT-1 y PILOT-2) confirmaron la eficacia significativa de Picankibart Inyectable:
Inicio de acción rápido: En la semana 12 de tratamiento, el 51,1 % de los pacientes del estudio PILOT-1 alcanzó el PASI 90 (aclaramiento de la lesión ≥90 %) y el 44,4 % de los pacientes del estudio PILOT-2 lo logró. En la semana 24 de tratamiento, la tasa de respuesta PASI 90 aumentó al 70,2 % en el estudio PILOT-1 y al 59,3 % en el estudio PILOT-2.
Mantenimiento a largo plazo: En la semana 48 de tratamiento, la tasa de respuesta PASI 90 se mantuvo alta, en el 70,2 % en el estudio PILOT-1 y en el 59,3 % en el estudio PILOT-2, con buena seguridad y sin informes de reacciones adversas graves.
Calidad de vida mejorada: Los resultados informados por los pacientes (PRO) mostraron que la inyección de Picankibart alivió significativamente síntomas como picazón y dolor, mejorando la calidad de vida de los pacientes.
Bajo riesgo de infección, mayor tranquilidad con el uso prolongado
En el ensayo clínico de fase III de Picankibart Inyectable, la incidencia de eventos adversos fue comparable a la del grupo placebo. Las reacciones adversas más frecuentes incluyeron nasofaringitis, cefaleas y reacciones en el lugar de la inyección, la mayoría de intensidad leve a moderada.
En comparación con los inhibidores de IL-23p40, presenta un menor riesgo de infección, lo que lo hace especialmente adecuado para pacientes que requieren un tratamiento prolongado. Además, el estudio no detectó un mayor riesgo de reactivación de tuberculosis, infecciones oportunistas ni neoplasias, lo que ofrece a los pacientes una opción de tratamiento más segura.
Llenar un vacío, beneficiar a millones de pacientes
La psoriasis es una enfermedad inflamatoria crónica y recidivante de la piel, con una prevalencia global de aproximadamente el 2% al 4%.
Los casos moderados a graves requieren tratamiento sistémico a largo plazo, pero los medicamentos tradicionales (como el metotrexato y la ciclosporina) conllevan riesgos de hepatotoxicidad y nefrotoxicidad, mientras que los fármacos biológicos, aunque eficaces, son costosos.
El lanzamiento de Picankibart Inyectable cubre un vacío en las terapias dirigidas a IL-23p19, y sus ventajas en términos de eficacia y seguridad prometen convertirlo en una opción de tratamiento de primera línea para la psoriasis moderada a grave.
Conclusión
La aprobación de la inyección de Picankibart es un claro ejemplo del progreso de mi país en el tratamiento de la psoriasis, pasando de «seguir» a «mantener el ritmo» e incluso a «liderar» el campo.
Su mecanismo innovador, su notable eficacia y sus ventajas en materia de seguridad brindan nuevas esperanzas a los pacientes e impulsan con fuerza el desarrollo de la industria biofarmacéutica de mi país.
En el futuro, con el lanzamiento de más medicamentos innovadores, los pacientes chinos disfrutarán de servicios médicos de mayor calidad y más accesibles.
FAQ About Inyección de Picankibart
Esto puede aumentar la probabilidad de infecciones bacterianas o virales; esté alerta a síntomas como resfriados recurrentes y neumonía.
La inyección de Picankibart es fabricada por Innovent Biologics (Suzhou) Co., Ltd.
La dosis recomendada es de 200 mg, administrada por vía subcutánea. Durante la fase inicial del tratamiento, se administran inyecciones en las semanas 0, 4 y 8, seguidas de terapia de mantenimiento cada 12 semanas (3 meses).
Pacientes con alergias: Este medicamento está contraindicado en pacientes alérgicos al principio activo o a los excipientes.
Pacientes con infecciones graves: Como tuberculosis activa, infecciones fúngicas, etc. La infección debe controlarse antes de evaluar el tratamiento.
Pacientes con afecciones especiales: Los pacientes con dermatitis atópica y asma concomitante deben tener precaución y evitar autoajustar su plan de tratamiento para el asma.
Mujeres embarazadas y lactantes: Existe información limitada; es necesario seguir estrictamente las instrucciones del médico y realizar una evaluación de riesgos.

