La leucemia con mutación T315I representa uno de los mayores desafíos en el tratamiento de las neoplasias hematológicas, ya que muchos inhibidores de tirosina cinasa disponibles presentan resistencia adquirida o primaria frente a esta alteración molecular.
A pesar de los avances en el tratamiento de las neoplasias hematológicas, los pacientes con leucemia con mutación T315I a menudo enfrentan opciones terapéuticas limitadas y un pronóstico desfavorable, lo que hace imperativo el desarrollo y la disponibilidad de fármacos más efectivos.
✨En este contexto, el Ponatinib (nombre comercial: Iclusig) se ha convertido en una terapia alternativa prometedora. Bloquea el crecimiento de células cancerosas al inhibir la actividad de proteínas anormales como BCR-ABL y presenta una eficacia única contra la mutación puntual T315I, superando las limitaciones de las terapias existentes y brindando nuevas esperanzas a los pacientes afectados por esta enfermedad.
DengyuePharma analizará el mecanismo de acción, los datos clínicos y la importancia del lanzamiento al mercado de Ponatinib para usted.
Contexto fisiopatológico de la indicación
Las leucemias asociadas a la mutación T315I se relacionan principalmente con dos entidades clínicas clave: la leucemia mieloide crónica Ph+ (LMC Ph+) y la leucemia linfoblástica aguda Ph+ (LLA Ph+).
La LMC Ph+ es un trastorno mieloproliferativo caracterizado por la translocación recíproca t(9;22)(q34.1;q11.2), que da lugar al gen de fusión BCR-ABL1, responsable de una actividad cinasa constitutiva que induce la proliferación descontrolada de células mieloides anormales.
🧬Por su parte, la LLA Ph+ es un subtipo de leucemia linfoblástica aguda en el que las células leucémicas presentan el cromosoma Filadelfia, lo que también genera la expresión del oncogén BCR-ABL1 y la consiguiente alteración de las vías de señalización celular de crecimiento y supervivencia.
La mutación T315I localizada en el dominio cinasa, ocurre en el dominio cinasa de BCR-ABL1 y es una de las causas más comunes de resistencia a los TKI de primera y segunda generación, como el imatinib, dasatinib y nilotinib.
Esta resistencia convierte a la leucemia con mutación T315I en un desafío terapéutico crítico, ya que los pacientes que la presentan suelen no responder a los tratamientos estándar o experimentan recaídas frecuentes.
Este escenario clínico hace necesario un tratamiento específico que pueda superar la resistencia mediada por la mutación T315I, lo que justifica la importancia del estudio y la aplicación de fármacos como el Ponatinib.
¿Qué es Ponatinib?–El único inhibidor de la tirosina quinasa eficaz contra la mutación T315I
El Ponatinib es un inhibidor de BCR-ABL de tercera generación, comercializado bajo el nombre genérico Ponatinib y el nombre comercial Iclusig, diseñado específicamente para abordar la resistencia mediada por mutaciones en el dominio cinasa de BCR-ABL1, incluyendo la mutación T315I.
Se trata de un fármaco de administración oral, con una estructura química que incluye enlace triple etinilo (grupo etinilo), lo que le confiere la capacidad de unirse de manera efectiva al sitio de unión del ATP en BCR-ABL1, tanto en su forma nativa como en sus variantes mutadas, incluyendo la T315I.
🤩A diferencia de los TKI anteriores, el Ponatinib presenta una acción actividad multiquinasa (multiquinase inhibitor), inhibiendo además de BCR-ABL1 otras cinasas involucradas en el crecimiento tumoral, la angiogénesis y la supervivencia celular, como PDGFRα, VEGFR2 y FGFR1, lo que amplía su espectro de acción terapéutica.
Su perfil farmacocinético se caracteriza por una larga semivida, lo que permite una administración diaria única, mejorando la adherencia del paciente al tratamiento.
Como fármaco innovador, el Ponatinib ha demostrado ser efectivo en el tratamiento de pacientes con leucemia con mutación T315I que no respondieron a otros TKI, posicionándose como una opción esencial en la estrategia terapéutica de estas enfermedades.
Mecanismo de acción de Ponatinib–¿Por qué puede suprimir la mutación T315I?
El mecanismo de acción principal de Ponatinib es apuntar con precisión e inhibir la actividad de la proteína de fusión BCR-ABL, bloqueando así las señales de proliferación anormales de las células leucémicas y, en última instancia, induciendo la apoptosis en las células cancerosas.
- Actividad específica: Se une específicamente a la proteína de fusión BCR-ABL e inhibe su actividad, un factor patogénico clave en la leucemia mieloide crónica (LMC) y la leucemia linfoblástica aguda con cromosoma Filadelfia positivo (LLA Ph+).
- Superación de la farmacorresistencia: Su estructura molecular única especialmente el
enlace triple etinilo (grupo etinilo) se une eficazmente a mutantes resistentes a fármacos como T315I, superando la resistencia a otros inhibidores de la tirosina quinasa (TKI). - Inhibición de amplio espectro: Además de BCR-ABL, también inhibe múltiples quinasas como VEGFR, PDGFR y FGFR, lo que podría potenciar los efectos antitumorales e influir en la angiogénesis.
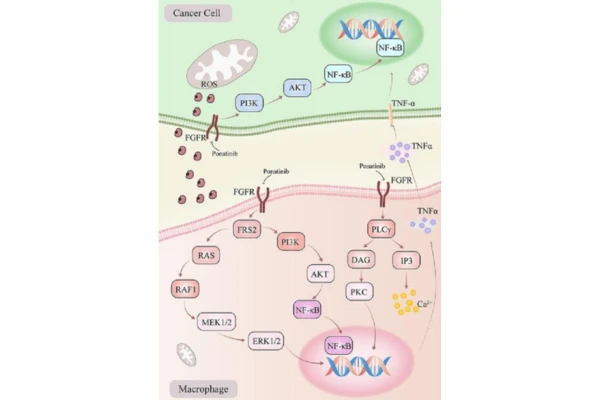
Este mecanismo único es lo que permite al Iclusig ser efectivo en el tratamiento de la leucemia con mutación T315I, superando las limitaciones de los tratamientos anteriores y ofreciendo una alternativa terapéutica viable.
Evidencia clínica de Ponatinib–¿Por qué Iclusig es la opción preferida para la mutación T315I?
🛏️La eficacia y seguridad del Ponatinib en el tratamiento de la leucemia con mutación T315I han sido demostradas en múltiples ensayos clínicos multicéntricos.
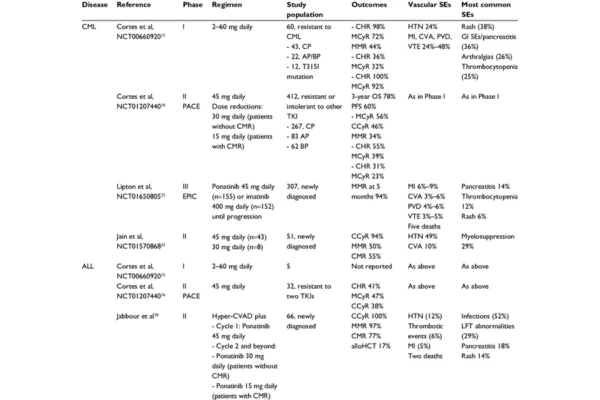
🧪Un estudio clave (Ensayo PACE, NCT01207440) evaluó la eficacia de Iclusig en 449 pacientes con LMC Ph+ o LLA Ph+ resistentes o intolerantes a otros TKI, incluyendo 64 pacientes con la mutación T315I.
Los resultados mostraron que en los pacientes con leucemia con mutación T315I, la tasa de respuesta hematológica completa (RHC) fue del 57%, y la tasa de respuesta citogenética completa (RCC) alcanzó el 40%, con una mediana de supervivencia global de 15,6 meses, lo que representa una mejora significativa en comparación con los tratamientos disponibles en ese momento.
Otros estudios confirmaron estos resultados, mostrando que el Iclusig logra respuestas sostenibles incluso en pacientes con enfermedad avanzada o en recaída.
En términos de seguridad, los efectos adversos más comunes incluyen hipertensión arterial, neutropenia, trombocitopenia, fatiga y dolor musculoesquelético, la mayoría de grado leve a moderado y manejables con ajustes de dosis o tratamiento sintomático.
La evidencia clínica acumulada confirma que el Ponatinib es un tratamiento innovador para la leucemia con mutación T315I, con una eficacia demostrada y un perfil de seguridad aceptable para pacientes con opciones terapéuticas limitadas.
Aprobación y significado de Ponatinib
El Ponatinib fue aprobado por la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) en diciembre de 2012 para el tratamiento de pacientes con LMC Ph+ en fase crónica, acelerada o blástica, y pacientes con LLA Ph+ resistentes o intolerantes a otros TKI, incluyendo aquellos con mutación T315I.
Posteriormente, recibió la aprobación de la Agencia Europea de Medicamentos (EMA) en julio de 2013, con la misma indicación, y ha sido aprobado en más de 50 países alrededor del mundo, incluyendo España y varios países de América Latina.
Iclusig fue aprobado por la National Medical Products Administration (NMPA) de China en septiembre de 2024 para la misma indicación.
Su aprobación representó un hito en el tratamiento de las leucemias resistentes a TKI, ya que por primera vez se disponía de un fármaco capaz de superar la resistencia mediada por la mutación T315I, una de las causas más difíciles de manejar en la práctica clínica.
El significado de esta aprobación radica en que cambió el pronóstico de los pacientes con leucemia con mutación T315I, transformando una condición con pronóstico desfavorable en una enfermedad manejable en muchos casos.
Además, su aprobación sentó un precedente para el desarrollo de otros TKI de tercera generación, fomentando la investigación en el campo de la terapia dirigida para neoplasias hematológicas.
Valor de mercado de Ponatinib en España, América Latina y el mundo
El mercado global del Ponatinib ha experimentado un crecimiento sostenido en los últimos años, impulsado por la prevalencia de leucemia mieloide crónica Ph+ y leucemia linfoblástica aguda Ph+, así como por la creciente detección de la mutación T315I gracias a los avances en las técnicas de diagnóstico molecular.
En España, el mercado del Ponatinib se beneficia de un sistema sanitario público robusto que incluye medicamentos innovadores en su lista de financiación, lo que garantiza el acceso a pacientes elegibles. El crecimiento en este país está impulsado por la mayor concienciación médica sobre la detección temprana de la mutación T315I y la adopción de guías clínicas que recomiendan el Iclusig como tratamiento de elección para pacientes resistentes.
En América Latina, el mercado está en expansión, con países como Brasil, México y Argentina liderando el crecimiento, gracias a la mejora del acceso a servicios de diagnóstico molecular y la incorporación de medicamentos innovadores en los planes de salud.
A pesar de que América Latina y España representan una porción menor del mercado global en comparación con Norteamérica, su potencial de crecimiento es significativo, debido a la creciente inversión en salud y la necesidad de abordar las necesidades terapéuticas no cubiertas en el tratamiento de la leucemia con mutación T315I.
📈Según análisis de la industria farmacéutica, se estima que el mercado global del Ponatinib alcanzará los 23 mil millones de dólares estadounidenses para 2030, con una tasa de crecimiento compuesto anual (CAGR) del 8,9% entre 2025 y 2030.
Resumen y perspectivas
En resumen, el Ponatinib en comprimidos ha emergido como un tratamiento revolucionario para la leucemia con mutación T315I, superando las limitaciones de los TKI de generaciones anteriores y brindando nuevas esperanzas a pacientes con leucemia mieloide crónica Ph+ y leucemia linfoblástica aguda Ph+ resistentes a otros tratamientos.
Su mecanismo de acción único, su eficacia clínica demostrada y su aprobación global han posicionado al Iclusig como un pilar en la terapia dirigida de estas leucemias, transformando el pronóstico de pacientes con una condición anteriormente considerada de mal pronóstico.
La agencia de exportación farmacéutica DengyuePharma continúa desempeñando un papel crucial en la disponibilidad global de este medicamento, asegurando que pacientes en España, América Latina y todo el mundo tengan acceso a esta terapia innovadora.

🔔A futuro, se espera que avances en la investigación clínica permitan optimizar el uso del Iclusig, incluyendo su combinación con otros fármacos (como inhibidores de PD1) para mejorar aún más los resultados terapéuticos, así como el desarrollo de nuevas formulaciones que aumenten su seguridad y adherencia.
Además, la mejora de las técnicas de diagnóstico molecular permitirá detectar la mutación T315I de manera más precoz, permitiendo iniciar el tratamiento con Ponatinib en etapas más tempranas de la enfermedad y maximizar su eficacia. Con estos avances, se espera seguir reduciendo la mortalidad asociada a la leucemia con mutación T315I y mejorar la calidad de vida de los pacientes afectados.
FAQ About leucemia con mutación T315I
La mutación T315I puede, en ocasiones, provocar que las células cancerosas desarrollen resistencia (incapacidad para responder) a los fármacos antineoplásicos inhibidores de la tirosina quinasa.
Para los pacientes portadores de la mutación T315I durante la crisis blástica, el panatinib, con o sin quimioterapia citotóxica, es una opción terapéutica viable.
Se detectó el estado mutacional del codón 315 en el transcrito de fusión BCR-ABL mediante pirosecuenciación de ARN basada en PCR. Se informa la proporción de productos de PCR mutantes y no mutantes en el codón 315.
La frecuencia de la mutación T315I varía según el tipo de leucemia y el historial de tratamiento del paciente. Se ha reportado que la frecuencia de la mutación T315I oscila entre el 2 % y el 20 % en pacientes con leucemia mieloide crónica (LMC).

