Los Inhibidores de HDAC han emergido como una categoría crucial de fármacos en la terapia epigenética contra el cáncer, revolucionando el tratamiento de diversas neoplasias hematológicas y sólidas.
Entre los cuales Chidamide (conocido comercialmente como Epidaza) es un inhibidor de HDAC, perteneciente a la clase de fármacos antitumorales reguladores epigenéticos. Inhibe selectivamente los subtipos de HDAC (como la clase I y la clase IIb), alterando la estructura de la cromatina y regulando la expresión de genes relacionados con la tumorigénesis. Esto lo ha convertido en un fármaco representativo de referencia.
Proveedor de medicamentos innovadores en China DengyuePharma, le brindará un análisis en profundidad de las características clínicas, el mecanismo de acción, el proceso de aprobación y el valor de mercado de Cidamid, explicando cómo los avances en los inhibidores de HDAC están cambiando el panorama global del tratamiento oncológico.
Comprensión de PTCL, el cáncer de mama y DLBCL (antecedentes de la indicación de Epidaza)
Las neoplasias objetivo de Epidaza incluyen el linfoma T periférico (PTCL), el cáncer de mama con receptores hormonales positivos y el linfoma difuso de células B grandes (DLBCL) con expresión positiva de MYC y BCL2.
El PTCL es un subtipo heterogéneo de linfoma no Hodgkin que representa entre el 10% y el 15% de todos los linfomas en países desarrollados, caracterizado por un pronóstico desfavorable y una escasez de opciones terapéuticas efectivas para casos recurrentes o refractarios.
El cáncer de mama con receptores hormonales positivos constituye el 70% de todos los casos de cáncer de mama, y aunque la terapia endocrina es el pilar del tratamiento, la resistencia a este tipo de terapia es un desafío común que limita la efectividad.
Por otro lado, el DLBCL con expresión positiva de MYC y BCL2 (DE-DLBCL) es un subtipo particularmente agresivo, con tasas de remisión completa bajas y un alto riesgo de progresión bajo los esquemas terapéuticos convencionales.
La alta morbilidad y mortalidad de estas enfermedades han hecho urgentemente necesarios fármacos innovadores con mecanismos de acción novedosos, lo que ha abierto la puerta a los Inhibidores de HDAC como Epidaza.
Comercialización de Chidamide
El proceso de comercialización de Chidamide ha sido un viaje marcado por hitos importantes en la investigación clínica y la aprobación regulatoria, con expansión gradual en indicaciones y mercados tanto nacionales como internacionales.
Hitos Clave de la Comercialización y Aprobación Nacional (China)
- Diciembre de 2014: Obtiene la primera aprobación de la NMPA para el tratamiento de pacientes con linfoma T periférico (PTCL) recurrente o refractario que recibieron al menos un ciclo de quimioterapia sistémica, llenando el vacío terapéutico en China para esta enfermedad.
- Julio de 2017: Se incluye en el Catálogo Nacional de Medicamentos de Seguro Médico, mejorando el acceso al fármaco y beneficiando a un mayor número de pacientes.
- Noviembre de 2019: La NMPA aprueba su segunda indicación: combinación con inhibidores de aromatasa para pacientes posmenopáusicas con cáncer de mama localmente avanzado o metastásico (receptores estrogénicos positivos, HER2 negativos) con recurrencia o progresión después de terapia endocrina. Se convierte en el primer fármaco de regulación epigenética aprobado mundialmente para tumores sólidos.
- Marzo de 2023: Aprobación en Taiwán, China, para combinación con exemestano en pacientes posmenopáusicas con cáncer de mama localmente avanzado o metastásico (receptores hormonales positivos, HER2 negativos) con recurrencia o deterioro después de terapia endocrina.
- Abril de 2024: Aprobación de la NMPA para combinación con el esquema R-CHOP en el tratamiento de pacientes con linfoma difuso de células B grandes (DLBCL) con expresión positiva de MYC y BCL2 y sin tratamiento previo.
- Diciembre de 2024: La indicación de DLBCL se incluye por primera vez en el Catálogo Nacional de Medicamentos de Seguro Médico, convirtiéndose en el único fármaco innovador oral para el tratamiento de primera línea de DLBCL dentro del sistema de seguros.
- Enero de 2026: La Autoridad Reguladora de Medicamentos de Macao aprobó la comercialización de Chidamide, se utiliza para tres indicaciones: linfoma periférico de células T, cáncer de mama y linfoma difuso de células B grandes..
Expansión Internacional y Aprobaciones en Otros Mercados
- Junio de 2021: Aprobación en Japón para el tratamiento monoterapéutico de pacientes adultos con leucemia linfocítica T adulta (ATL) recurrente o refractaria (R/R).
- Diciembre de 2021: Segunda aprobación en Japón: tratamiento monoterapéutico de pacientes con linfoma T periférico (PTCL) recurrente o refractario.
Todas estas etapas de aprobación y expansión están respaldadas por sólidos datos clínicos, que han confirmado la seguridad y eficacia de Epidaza en diversas poblaciones de pacientes y sentado las bases para su amplia aplicación clínica global.
¿Cuál es la Evidencia Clínica Correspondiente a la Nueva Indicación Aprobada?
Las nuevas indicaciones aprobadas de Chidamide están respaldadas por ensayos clínicos de fase III de alta calidad, con puntos finales claros que demuestran su beneficio terapéutico.
Para la indicación de cáncer de mama avanzado con receptores hormonales positivos, el ensayo clínico de fase III ACE demostró que la combinación de Epidaza y exemestano (un inhibidor de aromatasa) prolongó significativamente la supervivencia sin progresión (PFS) en pacientes posmenopáusicas con resistencia a la terapia endocrina.
El punto final principal del ensayo fue la PFS evaluada por un comité de revisión independiente (IRC), y los resultados mostraron que la mediana de PFS en el grupo combinado fue de 7.4 meses, en comparación con 3.8 meses en el grupo de exemestano solo (HR=0.75; IC del 95%: 0.58~0.98, P=0.033).
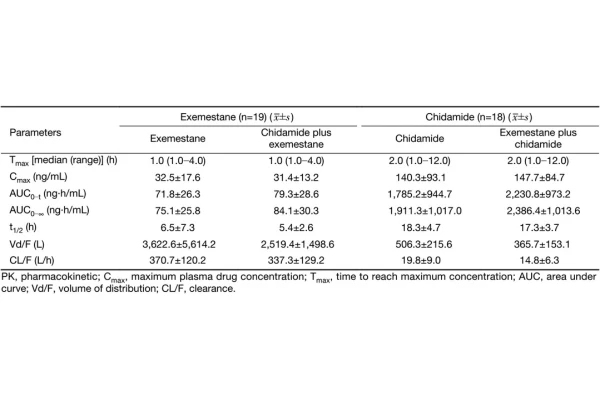
Evidencia Clínica para la Indicación de DLBCL con Expresión Positiva de MYC y BCL2
Para la indicación de DLBCL con expresión positiva de MYC y BCL2, el ensayo clínico de fase III DEB (NCT 04231448) demostró que la combinación de Chidamide y el esquema R-CHOP mejoró significativamente la tasa de remisión completa (CR) y la supervivencia sin eventos (EFS) en pacientes en fase inicial.
El punto final principal fue la CR, y los datos mostraron que la tasa de CR en el grupo combinado fue del 73.0%, en comparación con el 61.8% en el grupo control de R-CHOP (P=0.014); la tasa de EFS a 24 meses fue del 58.9% versus 46.2% (P=0.018).
Estas evidencias clínicas sólidas han sido fundamentales para la aprobación de las nuevas indicaciones y han confirmado que Epidaza es un agente terapéutico valioso en estos escenarios. La robustez de estos ensayos garantiza que los beneficios observados sean fiables y aplicables a la población clínica objetivo.
¿Qué Problemas Clave del Tratamiento Original Resuelve la Nueva Indicación Aprobada?
Las nuevas indicaciones aprobadas de Chidamide 5mg abordan varios problemas clave existentes en el tratamiento original de las enfermedades correspondientes.
En el caso del cáncer de mama con receptores hormonales positivos, la resistencia a la terapia endocrina es un desafío mayor que limita el pronóstico de los pacientes; el tratamiento original con inhibidores de aromatasa solo tiene una eficacia limitada en este grupo de pacientes.
La combinación de Epidaza y terapia endocrina resuelve este problema al superar la resistencia epigenética, proporcionando una nueva opción terapéutica efectiva para pacientes con resistencia a la terapia endocrina.
Resolución de Problemas en el Tratamiento del PTCL Recurrente o Refractario
Para el PTCL recurrente o refractario, el tratamiento original carecía de opciones estándar efectivas, y los pacientes tenían una tasa de remisión baja y una supervivencia corta.
La aprobación de Epidaza para esta indicación llenó un vacío terapéutico crucial, proporcionando un agente oral eficaz que mejora la calidad de vida de los pacientes.
Resolución de Problemas en el Tratamiento del DLBCL con Expresión Positiva de MYC y BCL2
En el caso del DLBCL con expresión positiva de MYC y BCL2, el esquema R-CHOP convencional tiene una tasa de remisión completa baja y un alto riesgo de progresión, lo que lleva a un pronóstico desfavorable.
La combinación de Epidaza y R-CHOP resuelve este problema al aumentar significativamente la tasa de remisión completa y reducir el riesgo de progresión de la enfermedad, mejorando el pronóstico de estos pacientes de alto riesgo.
En resumen, Chidamide ha abordado las deficiencias del tratamiento tradicional en varios escenarios oncológicos, brindando nuevas esperanzas a los pacientes.
Mecanismo de Acción de la Chidamida
El mecanismo de acción de la Chidamida se basa en su propiedad de inhibir selectivamente las isoenzimas de HDAC, lo que la diferencia de otros Inhibidores de HDAC no selectivos.
Específicamente, Chidamide actúa sobre las isoenzimas 1, 2 y 3 de la clase I y la isoenzima 10 de la clase IIb de HDAC . Al inhibir estas enzimas, Chidamide aumenta los niveles de acetilación de las histonas H3 y H4 en las células tumorales, lo que altera la estructura de la cromatina y regula la expresión génica.
Este cambio epigenético conduce a varios efectos antitumorales:
- Primero, induce la detención del ciclo celular y la apoptosis de las células tumorales;
- Segundo, activa las células asesinas T específicas de antígenos y las células natural killer (NK), mejorando la respuesta inmunitaria antitumoral;
- Tercero, inhibe la transformación fenotípica de las células tumorales y la actividad pro-resistencia y pro-metástasis del microambiente tumoral.
- Cuatro, Epidaza también regula negativamente las vías de señalización PI3K/AKT y MAPK/RAS, que son cruciales para la proliferación y supervivencia de las células tumorales.
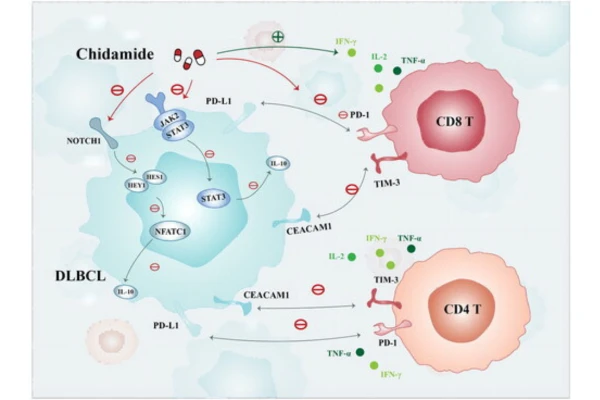
Este mecanismo de acción múltiple y selectivo explica su eficacia en diversos tipos de cáncer y su perfil de seguridad relativamente favorable.
Ventajas de las tabletas de chidamide en comparación con vorinostat y romidepsina
| Categoría de Ventaja | Descripción Detallada | Ventajas de las tabletas de chidamide en comparación con (ej: vorinostat, romidepsin) |
|---|---|---|
| Menor Toxicidad | Su selectividad por las isoenzimas de HDAC (clase I: 1,2,3; clase IIb: 10) reduce los efectos tóxicos no hematológicos, especialmente las toxicidades gastrointestinales (náuseas, vómitos, estreñimiento). | Los Inhibidores de HDAC no selectivos tienen una mayor incidencia de toxicidades gastrointestinales; los datos clínicos demuestran menor incidencia en pacientes tratados con Chidamide. |
| Conveniencia de Administración | Es un fármaco oral con buena biodisponibilidad, lo que mejora el cumplimiento del tratamiento en pacientes con enfermedades crónicas o avanzadas. | Fármacos como romidepsin requieren administración intravenosa, lo que reduce la comodidad para los pacientes en comparación con la vía oral de Epidaza. |
| Efecto Sinérgico Favorable | Muestra un efecto sinérgico cuando se combina con otros fármacos antitumorales, ampliar su espectro de acción terapéutico. | En modelos preclínicos de AML, una baja dosis de Chidamide tuvo un mejor efecto sinérgico con el inhibidor de BCL2 ABT-199 en comparación con romidepsin. |
| Amplio Espectro de Acción (Primer en su Clase) | Es el primer Inhibidor de HDAC aprobado globalmente para el tratamiento de tumores sólidos (cáncer de mama), demostrando su eficacia en tanto neoplasias hematológicas como sólidas. | Muchos Inhibidores de HDAC similares se limitan a indicaciones de neoplasias hematológicas; Epidaza rompe esta barrera al cubrir tumores sólidos. |
Estas ventajas integradas hacen que Epidaza sea un agente terapéutico único entre los Inhibidores de HDAC, con un valor clínico significativo en el tratamiento oncológico.
Valor de Mercado Global de la Chidamida
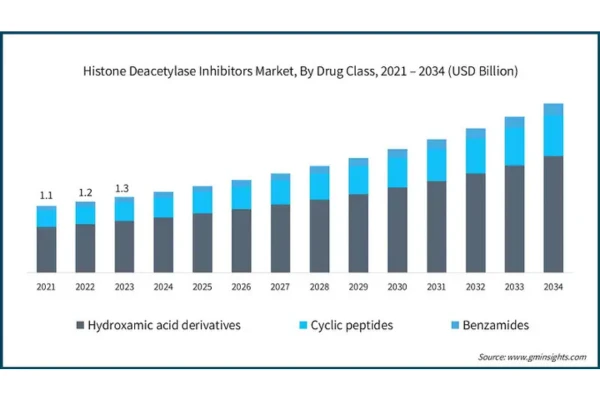
📈El valor de mercado global de Chidamide ha experimentado un crecimiento constante en los últimos años y se espera que siga expandiéndose en el futuro, impulsado por su amplia aprobación de indicaciones y su creciente reconocimiento clínico.
Según informes de mercado, el tamaño del mercado global de Chidamide se estimó en 300 millones de dólares estadounidenses en 2024 y se espera que alcance los 800 millones de dólares estadounidenses para 2033, con una tasa de crecimiento anual compuesto (CAGR) del 12.3% entre 2026 y 2033.
Geográficamente, América del Norte es el mercado dominante en la actualidad, debido a la alta prevalencia de linfomas y la avanzada infraestructura sanitaria.
Sin embargo, el Asia-Pacífico, especialmente China, se está convirtiendo en un mercado de gran potencial, impulsado por las inversiones crecientes en investigación oncológica y la creciente población de pacientes.
El crecimiento del mercado también se ve respaldado por la expansión de las indicaciones de Chidamide, su inclusión en guías clínicas autoritarias (como las guías CSCO) y la mejora del acceso a los medicamentos en países en desarrollo .
Además, el mercado global de los Inhibidores de HDAC se espera que alcance los 3 mil millones de dólares estadounidenses para 2026, lo que crea un entorno favorable para el crecimiento de Epidaza.
El continuo crecimiento del mercado refleja la confianza clínica en Epidaza y su capacidad para satisfacer las necesidades no cubiertas de los pacientes.
Resumen y Perspectivas
En resumen, Chidamide (Epidaza), como un representante innovador de los Inhibidores de HDAC, ha logrado importantes avances en el tratamiento de varios tipos de cáncer, incluyendo el PTCL, el cáncer de mama con receptores hormonales positivos y el DLBCL con expresión positiva de MYC y BCL2.
Su proceso de comercialización está respaldado por sólidos datos clínicos, su mecanismo de acción selectivo le confiere ventajas únicas en términos de eficacia y seguridad, y su valor de mercado global se espera que siga creciendo.
A largo plazo, se espera que la investigación clínica continúe explorando nuevas indicaciones de Epidaza, como su combinación con terapias de inmunoensayo o otros fármacos dirigidos, para ampliar su espectro de acción y mejorar aún más los resultados de los pacientes.
Además, con el desarrollo de la medicina de precisión, la identificación de marcadores moleculares predictivos de respuesta a Chidamide ayudará a optimizar la selección de pacientes, maximizando el beneficio terapéutico.
En el campo dinámico de los Inhibidores de HDAC, Epidaza seguirá desempeñando un papel destacado, y DengyuePharma continuará siendo un motor importante en la innovación farmacéutica oncológica global.

FAQ About Inhibidores de HDAC
El ácido hidroxámico suberoilanilida (SAHA/Vorinostat/Zolinza), la tricostatina A (TSA) y el PXD-101 son inhibidores pan-HDAC basados en ácido hidroxámico. El depsipéptido (FK228/romidepsina/ISTODAX®) es un péptido cíclico natural de tipo profármaco que inhibe selectivamente HDAC1 y HDAC2.
Enzima que extrae de las histonas (proteínas que se encuentran en los cromosomas) una pequeña molécula que se llama grupo acetilo.
El tucidinostat (DCI, también conocido como chidamida y comercializado bajo las marcas Epidaza e Hiyasta) es un inhibidor de la histona desacetilasa (IDH) desarrollado en China. También se conocía como HBI-8000.
Los ácidos grasos de cadena corta, como el ácido valproico (VPA) y el ácido butírico, son específicos de las HDAC de clase I y IIa. MS 275 (entinolida) y FK228 (romedixina) pertenecen a la clase de las benzamidas, mientras que los depéptidos se utilizan para inhibir las HDAC de clase I.

