El 10 de noviembre de 2025, Novartis anunció que su innovador fármaco, remibutinib en comprimidos, había sido aprobado oficialmente por la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) para el tratamiento de pacientes adultos con urticaria crónica espontánea (CSU) que seguían presentando síntomas tras el tratamiento con antihistamínicos H1.
Este medicamento es el primer inhibidor oral de la tirosina quinasa de Bruton (BTK) aprobado en el mundo para la CSU, lo que proporciona a los pacientes una nueva opción de tratamiento.

Mecanismo revolucionario: Bloqueo preciso de las vías inmunitarias
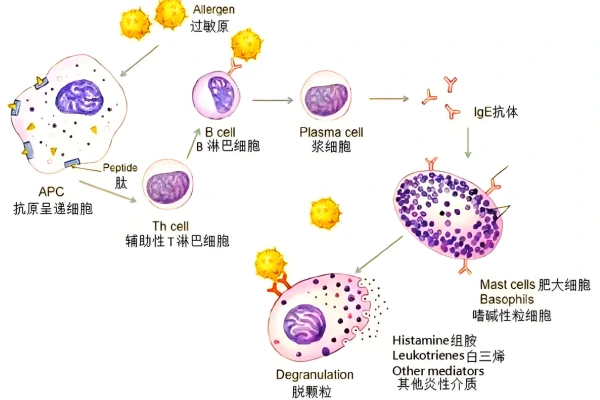
La CSU es una enfermedad autoinmune crónica mediada por mastocitos, y los pacientes suelen presentar síntomas como ronchas pruriginosas y angioedema debido a la liberación de histamina. Los antihistamínicos tradicionales tienen una eficacia limitada en más de la mitad de los pacientes.
Remibutinib actúa sobre la vía de señalización BTK inhibiéndola, bloqueando la liberación de histamina y mediadores proinflamatorios de los mastocitos, controlando así la progresión de la enfermedad en su origen.
Los estudios clínicos demuestran que el medicamento puede aliviar significativamente los síntomas en tan solo dos semanas y tiene un buen perfil de seguridad, sin necesidad de seguimiento de laboratorio.
Necesidad urgente de los pacientes: cubrir la brecha de tratamiento
De los aproximadamente 1,7 millones de pacientes con CSU en Estados Unidos, más de la mitad no responden bien a los tratamientos existentes.
El profesor Mark Lebwohl, de la Escuela de Medicina Icahn del Hospital Mount Sinai, señala que los síntomas de la CSU son impredecibles y afectan gravemente la calidad de vida de los pacientes.
La aprobación de remibrutinib proporciona un régimen oral altamente eficaz y conveniente para pacientes con enfermedad «refractaria», que requiere una dosificación dos veces al día sin inyección.

Expansión global: una nueva esperanza para el control preciso de enfermedades
Esta aprobación marca el inicio de una nueva era para el tratamiento dirigido de la CSU. Novartis declaró que el fármaco dará prioridad a los pacientes en Estados Unidos y que planea expandirse al mercado global.
Los expertos del sector consideran que su éxito constituye una referencia importante para la terapia dirigida de enfermedades autoinmunes.
Además, Novartis ha presentado solicitudes de autorización de comercialización para los comprimidos de remibutinib para el tratamiento de la CSU en varios países y regiones, incluidos la UE, Japón y China.
La solicitud de autorización de comercialización de este producto en China ha sido incluida en el proceso de revisión prioritaria de la NMPA.
Dengyue Pharma cree que, con el lanzamiento de remibrutinib, los pacientes con urticaria crónica espontánea (UCE) lograrán un control de los síntomas más preciso y duradero, mejorando así su calidad de vida a largo plazo.
Seguiremos supervisando el lanzamiento del producto y ofreciendo canales de adquisición oportunos y convenientes, así como información sobre el medicamento.

FAQ About Remibrutinib:
Remitinib está indicado para el tratamiento de la CUS en adultos cuyos síntomas no han mejorado con antihistamínicos H1. No está aprobado para el tratamiento de otros tipos de urticaria. Remitinib inhibe la tirosina quinasa de Bruton de forma altamente selectiva, potente y mediante un enlace covalente.
Aparte de una mayor incidencia de nasofaringitis, infecciones de las vías respiratorias superiores y petequias, la incidencia de eventos adversos con rebrutinib fue similar a la observada con placebo.
El 30 de septiembre de 2025, rebrutinib recibió la aprobación de la FDA.
Novartis.

